Das Herpes-Simplex-Virus 1 (HSV-1) ist eines der Viren, die die meisten Menschen lebenslang im Körper tragen. Nach der Infektion im Kleinkindalter „schläft” das Virus in spezialisierten Zellen in unserem Körper, bei HSV-1 sind das Nervenzellen im Gesicht. Diese Zellen leiten bspw. Empfindungen – Berührungen, Hitz – von unseren Lippen ins Gehirn. Manchmal kann das HSV-1-Virus aber auch „aufwachen“, und sich wieder vermehren. Es „reaktiviert“ in den Nervenzellen und wandert in Richtung Lippen. Dort ist die schnelle Vermehrung des Virus dann als Fieberblase sichtbar und spürbar. Das ist schmerzhaft und lästig, lässt sich aber mit entsprechenden Salben behandeln. Manchmal wandert das Virus aber in die falsche Richtung, ins Gehirn*. Dort kann es eine lebensbedrohliche Hirnentzündung verursachen – davon gibt es in Deutschland einige Hundert Fälle pro Jahr. Und auch wenn eine schnelle Behandlung das Leben der Patientinnen und Patienten rettet, treten meistens bleibende Spätfolgen auf wie epileptische Anfälle. Grund dafür sind wahrscheinlich beschädigte Nervenzellen. Die Frage ist nun, warum eine HSV-1-Gehirnentzündung zu diesen Spätfolgen führt, und wie sie verhindert werden könnte.
Eine Virusinfektion erforscht man am besten mit Proben aus Menschen: also bspw. etwas Gewebe oder Blut zu entnehmen, und mit verschiedenen Experimenten feststellen, welche molekularen und zellulären Prozesse stattfinden. Praktisch ist das aber oft kaum möglich. Gerade aus dem Gehirn können nur in seltensten Fälle Proben entnommen werden. Und vor allem nicht für wissenschaftliche Forschung – wenn, dann nur für ein Diagnoseverfahren, das der betroffenen Person direkt zu Gute kommt. Es braucht daher sogenannte „Krankheitsmodelle“: ein experimentelles System, mit dem wir die Hirnentzündung nach HSV-1-Infektion nachbilden können. Und hier kommen die Minihirne ins Spiel, die wir in unserer Publikation „Modelling viral encephalitis caused by herpes simplex virus 1 infection in cerebral organoids“ untersucht haben.
Von Zellen zu Organoiden
Schon seit Jahrzehnten wird in der Forschung mit menschlichen Zellen gearbeitet. Oft ist das aber nur ein bestimmter Typ von Zellen, die in einer flachen Plastikschale wachsen – nicht zu vergleichen mit einem menschlichen Organ, in dem Dutzende verschiedene Zelltypen in einer dreidimensionalen Struktur organisiert sind. Um das abzubilden, sind in den letzten 10 Jahren die „Organoide“ entwickelt worden. Hirnorganoide etwa, „Minihirne“ sind kleine Kügelchen, ein bis drei Millimeter groß, in denen sich Millionen verschiedene Zelltypen ähnlich wie in unserem Gehirn anordnen.
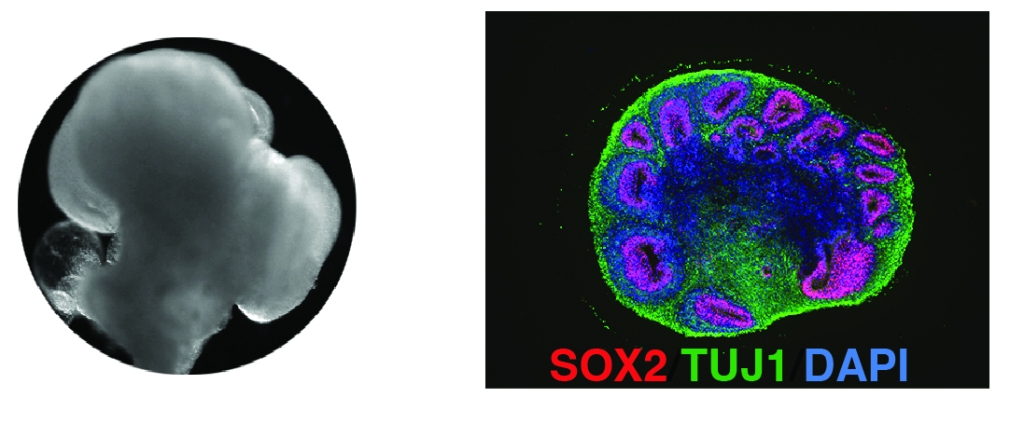
Auch wenn zu einem richtigen Gehirn noch sehr viel fehlt: Mit den Hirnorganoiden haben wir also nun ein deutlich besseres Krankheitsmodell für Herpes-Hirnentzündungen, und können im Labor untersuchen, wie die Infektion die Nervenzellen schädigt.
Gute und schlechte Seiten des Immunsystems
Im Labor haben wir dann die Hirnorganoide mit dem Virus infiziert. Gegen HSV-1 gibt es mit Aciclovir ein jahrzehntealtes, wirksames Medikament. Auch in den Hirnorganoiden hat Aciclovir das Virus gut an der Vermehrung gehindert. Trotzdem litten die Nervenzellen in den Organoiden, auch wenn sie gar nicht infiziert wurden. Einen Hinweis darauf gab die Einzelzellsequenzierung. Mit dieser Methode können wir für Tausende einzelner Zellen in den Hirnorganoiden feststellen, welche Gene sie in Folge der Infektion wie stark aktivieren. Damit sahen wir, dass nach dem Kontakt der Organoide mit dem Virus ein Teils des angeborenen Immunsystems angeschaltet wird. Dieser sogenannte TNF-Signalweg trägt dazu bei, eine Entzündung – also die notwendige Aktivierung des Immunsystems zur Bekämpfung des Virus – auszulösen. Aber, für die Nervenzellen kann das problematische Folgen haben. Wir prüften also, ob das Bremsen dieses Signalweges den Nervenzellen in den Organoiden helfen würde – und das war tatsächlich der Fall. Vor allem die kombinierte Behandlung, also Aciclovir gegen die Virusvermehrung und ein Medikament gegen den TNF-Signalweg, „rettete“ die Hirnorganoide **.
Und jetzt?
Ganz überraschend sind unsere Erkenntnisse nicht, und es gab tatsächlich auch schon Versuche in der Klinik, entzündungshemmende Medikamente bei Herpes-Hirnentzündung anzuwenden. In der Praxis ist das nicht so einfach, weil „entzündungshemmend“ immer bedeutet, dass das Immunsystem auch daran gehindert wird, das Virus zu bekämpfen. Das gilt vor allem für häufig angewendete, breit wirksame „Entzündungshemmer“ etwa aus der Familie der Corticoide. Solche detaillierten molekularen Untersuchungen wie unsere können nun viel exakter definieren, was genau im Immunsystem den Schaden verursacht. Mit diesen Erkenntnissen kann man dann versuchen, genau passenden Medikamente zu finden. Im Hinblick darauf zeigt unsere Publikation auf, wie wertvoll Hirnorganoide für diese Forschung sein können.
Modelling viral encephalitis caused by herpes simplex virus 1 infection in cerebral organoids
Agnieszka Rybak-Wolf, Emanuel Wyler, Tancredi Massimo Pentimalli, Ivano Legnini, Anna Oliveras Martinez, Petar Glažar, Anna Loewa, Seung Joon Kim, Benedikt B. Kaufer, Andrew Woehler, Markus Landthaler & Nikolaus Rajewskys. Nature Microbiology (2023)
https://www.nature.com/articles/s41564-023-01405-y
* Es ist nicht ganz klar, ob diese Hirnentzündungen durch Reaktivierungen des Virus verursacht werden, oder durch Neuinfektionen. Ersteres wird als wahrscheinlicher angenommen.
** Wem das bekannt vorkommt: bei COVID-19 haben wir einen ähnlichen Effekt festgestellt. Dort war das Bremsen der Entzündung alleine noch deutlich effizienter als hier beim Herpes-Simplex-Virus, siehe https://emanuelwyler.wordpress.com/2021/08/18/coronainfo-funfter-teil/#1222.
