Das Herpes-Simplex-Virus 1 (HSV-1) ist eines der Viren, die die meisten Menschen lebenslang im Körper tragen. Nach der Infektion im Kleinkindalter „schläft” das Virus in spezialisierten Zellen in unserem Körper, bei HSV-1 sind das Nervenzellen im Gesicht. Diese Zellen leiten bspw. Empfindungen – Berührungen, Hitz – von unseren Lippen ins Gehirn. Manchmal kann das HSV-1-Virus aber auch „aufwachen“, und sich wieder vermehren. Es „reaktiviert“ in den Nervenzellen und wandert in Richtung Lippen. Dort ist die schnelle Vermehrung des Virus dann als Fieberblase sichtbar und spürbar. Das ist schmerzhaft und lästig, lässt sich aber mit entsprechenden Salben behandeln. Manchmal wandert das Virus aber in die falsche Richtung, ins Gehirn*. Dort kann es eine lebensbedrohliche Hirnentzündung verursachen – davon gibt es in Deutschland einige Hundert Fälle pro Jahr. Und auch wenn eine schnelle Behandlung das Leben der Patientinnen und Patienten rettet, treten meistens bleibende Spätfolgen auf wie epileptische Anfälle. Grund dafür sind wahrscheinlich beschädigte Nervenzellen. Die Frage ist nun, warum eine HSV-1-Gehirnentzündung zu diesen Spätfolgen führt, und wie sie verhindert werden könnte.
Eine Virusinfektion erforscht man am besten mit Proben aus Menschen: also bspw. etwas Gewebe oder Blut zu entnehmen, und mit verschiedenen Experimenten feststellen, welche molekularen und zellulären Prozesse stattfinden. Praktisch ist das aber oft kaum möglich. Gerade aus dem Gehirn können nur in seltensten Fälle Proben entnommen werden. Und vor allem nicht für wissenschaftliche Forschung – wenn, dann nur für ein Diagnoseverfahren, das der betroffenen Person direkt zu Gute kommt. Es braucht daher sogenannte „Krankheitsmodelle“: ein experimentelles System, mit dem wir die Hirnentzündung nach HSV-1-Infektion nachbilden können. Und hier kommen die Minihirne ins Spiel, die wir in unserer Publikation „Modelling viral encephalitis caused by herpes simplex virus 1 infection in cerebral organoids“ untersucht haben.
Von Zellen zu Organoiden
Schon seit Jahrzehnten wird in der Forschung mit menschlichen Zellen gearbeitet. Oft ist das aber nur ein bestimmter Typ von Zellen, die in einer flachen Plastikschale wachsen – nicht zu vergleichen mit einem menschlichen Organ, in dem Dutzende verschiedene Zelltypen in einer dreidimensionalen Struktur organisiert sind. Um das abzubilden, sind in den letzten 10 Jahren die „Organoide“ entwickelt worden. Hirnorganoide etwa, „Minihirne“ sind kleine Kügelchen, ein bis drei Millimeter groß, in denen sich Millionen verschiedene Zelltypen ähnlich wie in unserem Gehirn anordnen.
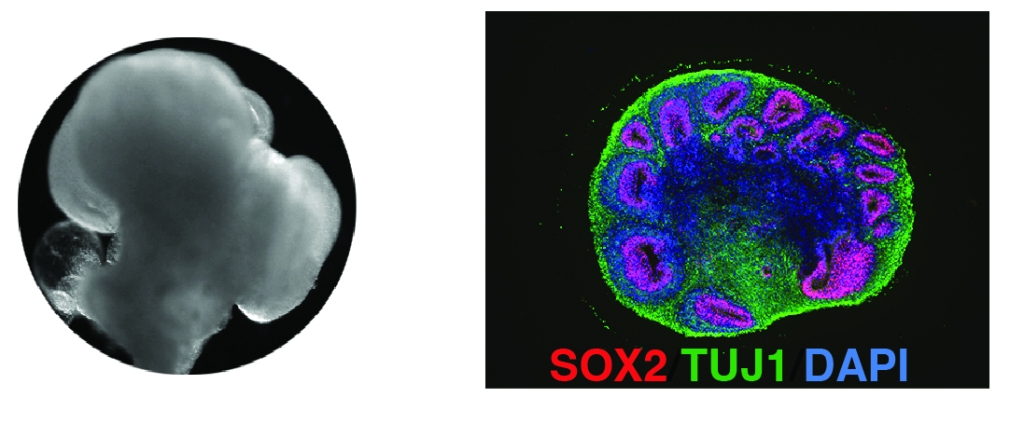
Auch wenn zu einem richtigen Gehirn noch sehr viel fehlt: Mit den Hirnorganoiden haben wir also nun ein deutlich besseres Krankheitsmodell für Herpes-Hirnentzündungen, und können im Labor untersuchen, wie die Infektion die Nervenzellen schädigt.
Gute und schlechte Seiten des Immunsystems
Im Labor haben wir dann die Hirnorganoide mit dem Virus infiziert. Gegen HSV-1 gibt es mit Aciclovir ein jahrzehntealtes, wirksames Medikament. Auch in den Hirnorganoiden hat Aciclovir das Virus gut an der Vermehrung gehindert. Trotzdem litten die Nervenzellen in den Organoiden, auch wenn sie gar nicht infiziert wurden. Einen Hinweis darauf gab die Einzelzellsequenzierung. Mit dieser Methode können wir für Tausende einzelner Zellen in den Hirnorganoiden feststellen, welche Gene sie in Folge der Infektion wie stark aktivieren. Damit sahen wir, dass nach dem Kontakt der Organoide mit dem Virus ein Teils des angeborenen Immunsystems angeschaltet wird. Dieser sogenannte TNF-Signalweg trägt dazu bei, eine Entzündung – also die notwendige Aktivierung des Immunsystems zur Bekämpfung des Virus – auszulösen. Aber, für die Nervenzellen kann das problematische Folgen haben. Wir prüften also, ob das Bremsen dieses Signalweges den Nervenzellen in den Organoiden helfen würde – und das war tatsächlich der Fall. Vor allem die kombinierte Behandlung, also Aciclovir gegen die Virusvermehrung und ein Medikament gegen den TNF-Signalweg, „rettete“ die Hirnorganoide **.
Und jetzt?
Ganz überraschend sind unsere Erkenntnisse nicht, und es gab tatsächlich auch schon Versuche in der Klinik, entzündungshemmende Medikamente bei Herpes-Hirnentzündung anzuwenden. In der Praxis ist das nicht so einfach, weil „entzündungshemmend“ immer bedeutet, dass das Immunsystem auch daran gehindert wird, das Virus zu bekämpfen. Das gilt vor allem für häufig angewendete, breit wirksame „Entzündungshemmer“ etwa aus der Familie der Corticoide. Solche detaillierten molekularen Untersuchungen wie unsere können nun viel exakter definieren, was genau im Immunsystem den Schaden verursacht. Mit diesen Erkenntnissen kann man dann versuchen, genau passenden Medikamente zu finden. Im Hinblick darauf zeigt unsere Publikation auf, wie wertvoll Hirnorganoide für diese Forschung sein können.
Modelling viral encephalitis caused by herpes simplex virus 1 infection in cerebral organoids
Agnieszka Rybak-Wolf, Emanuel Wyler, Tancredi Massimo Pentimalli, Ivano Legnini, Anna Oliveras Martinez, Petar Glažar, Anna Loewa, Seung Joon Kim, Benedikt B. Kaufer, Andrew Woehler, Markus Landthaler & Nikolaus Rajewskys. Nature Microbiology (2023)
https://www.nature.com/articles/s41564-023-01405-y
* Es ist nicht ganz klar, ob diese Hirnentzündungen durch Reaktivierungen des Virus verursacht werden, oder durch Neuinfektionen. Ersteres wird als wahrscheinlicher angenommen.
** Wem das bekannt vorkommt: bei COVID-19 haben wir einen ähnlichen Effekt festgestellt. Dort war das Bremsen der Entzündung alleine noch deutlich effizienter als hier beim Herpes-Simplex-Virus, siehe https://emanuelwyler.wordpress.com/2021/08/18/coronainfo-funfter-teil/#1222.
Vor drei Jahren begann unsere Forschung am Coronavirus SARS-CoV-2, das die Krankheit COVID-19 auslöst. Ein großer Teil unserer Arbeit dreht sich um die molekularen Prozesse nach einer Ansteckung mit dem Virus. Auch wenn erst einmal der reine Erkenntnisgewinn im Vordergrund steht: gerade bei so akuten Themen stellt sich immer die Frage, ob und wie man all dieses Wissen denn anwenden kann. Und eigentlich klingt das ja auch ganz einfach: wenn man genau weiß, was nach einer Ansteckung geschieht, kann man mit Medikamenten so eingreifen, dass das Virus möglichst wenig Schaden anrichten kann. Das ist auch der Weg, den wir vor drei Jahren eingeschlagen haben – im Wissen darum, dass die Realität viel komplizierter ist, es viel zu lernen gibt, und sehr viele Möglichkeiten zu scheitern.
Aus dem ersten Projekt im Frühling 2020 folgerten wir, dass ein Medikament, das das Enzym Hsp90 in menschlichen Zellen hemmt, vielversprechend sein könnte. Denn damit, so die ersten Experimente, könnten gleich beide der zentralen Ziele bei COVID-19 angegangen werden: erstens die Vermehrung des Virus zu bremsen, und zweitens die bisweilen überschießende Reaktion des Immunsystems auf das Virus. Denn so sehr eine solche „Entzündung“ stattfinden muss, um das Virus in den Griff zu kriegen: was bei milder Erkrankung als „Erkältung“ spürbar ist, kann sich zu einer lebensbedrohlichen Lungenentzündung auswachsen oder zu Blutgefäßschäden führen – und auch bei Langzeitfolgen („LongCovid“/“PostCovid“) eine Rolle spielen.
Die ersten Experimente damals wurden in menschlichen Zellen gemacht – aber in einem künstlichen System, in Nährmedien in Plastikschalen. So anzufangen ist der natürliche erste Schritt, aber vieles, was unter diesen Bedingungen Erfolge verspricht, funktioniert im Menschen dann nicht (dazu gehören auch zu Pandemiebeginn so gehypte Dinger wie Remdesivir, Ivermectin oder Chloroquin). Die nächste Etappe in solchen Tests waren daher Tierversuche – um die Frage zu beantworten: funktioniert im ganzen Organismus, was in der Plastikschale Wirkung zeigt?

Um diese Frage zu klären, arbeiteten wir mit dem Institut für Virologie der Freien Universität Berlin, sowie der Firma Aldeyra aus den USA zusammen – letztere produziert einen Hsp90-Hemmer, der auch schon in klinischen Studien bei Menschen getestet wurde, insbesondere für verschiedene Krebsarten. Die Studie erschien kürzlich als „preprint“, d.h. in noch nicht begutachteter Form.
Als erstes hatten wir nochmals die Wirkung des Hsp90-Hemmers in menschlichen Lungenzellen getestet, und vor allem geschaut wieviel es braucht um die Virusvermehrung bzw. die Entzündung abzubremsen.
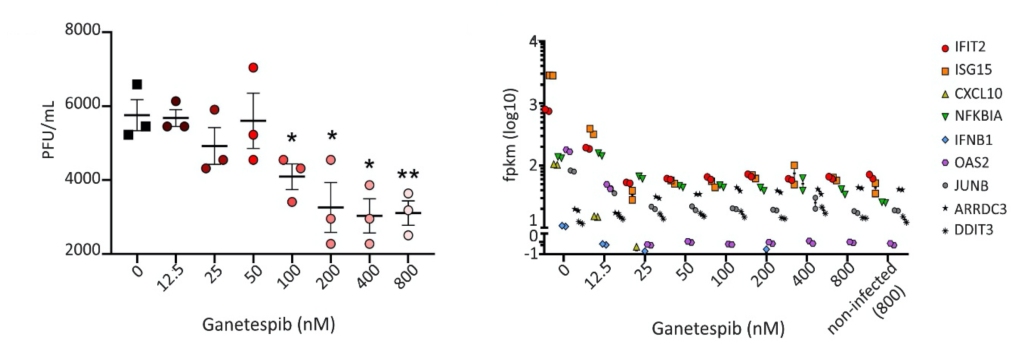
Etwas überraschend war, dass es mehr vom Hsp90-Hemmer Ganetespib braucht, um das Virus, als um die Entzündung zu bremsen. Das war wichtig zu wissen, denn später in den Tierexperimenten sahen wir, dass im Hamsterkörper die zum Bremsen des Virus notwendige Menge gar nicht oder nur kurz erreicht wird – das Medikament wurde wahrscheinlich zu schnell wieder ausgeschieden.
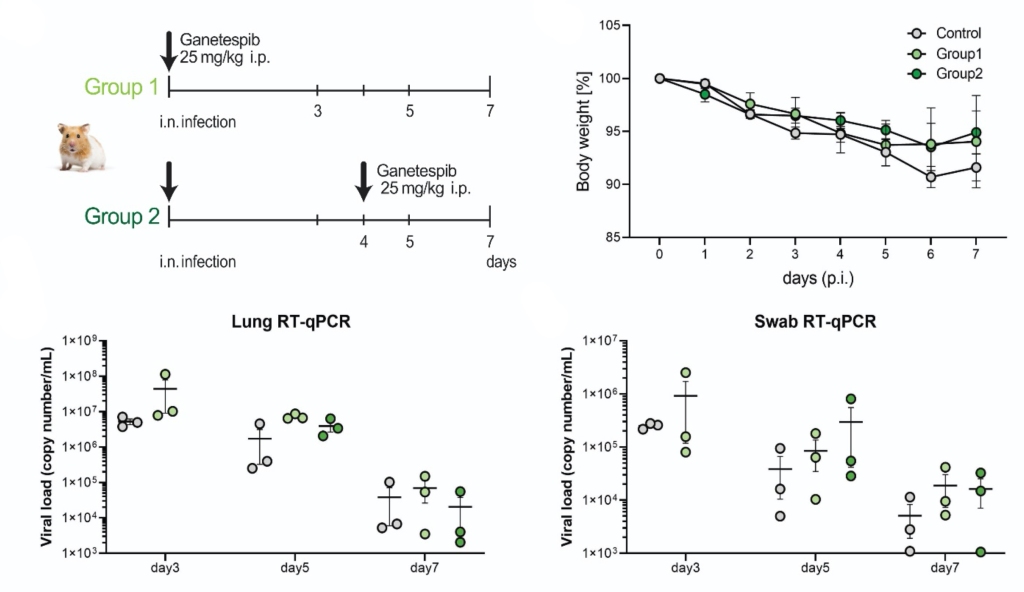
Mit dem Hsp90-Hemmer Ganetespib wurden die Tiere etwas weniger krank, die Menge Virus blieb aber, nicht unerwartet, gleich. Eine genaue Inspektion der Lunge zeigte tatsächlich auch eine in Maßen reduzierte Lungen- und Blutgefäßentzündung.
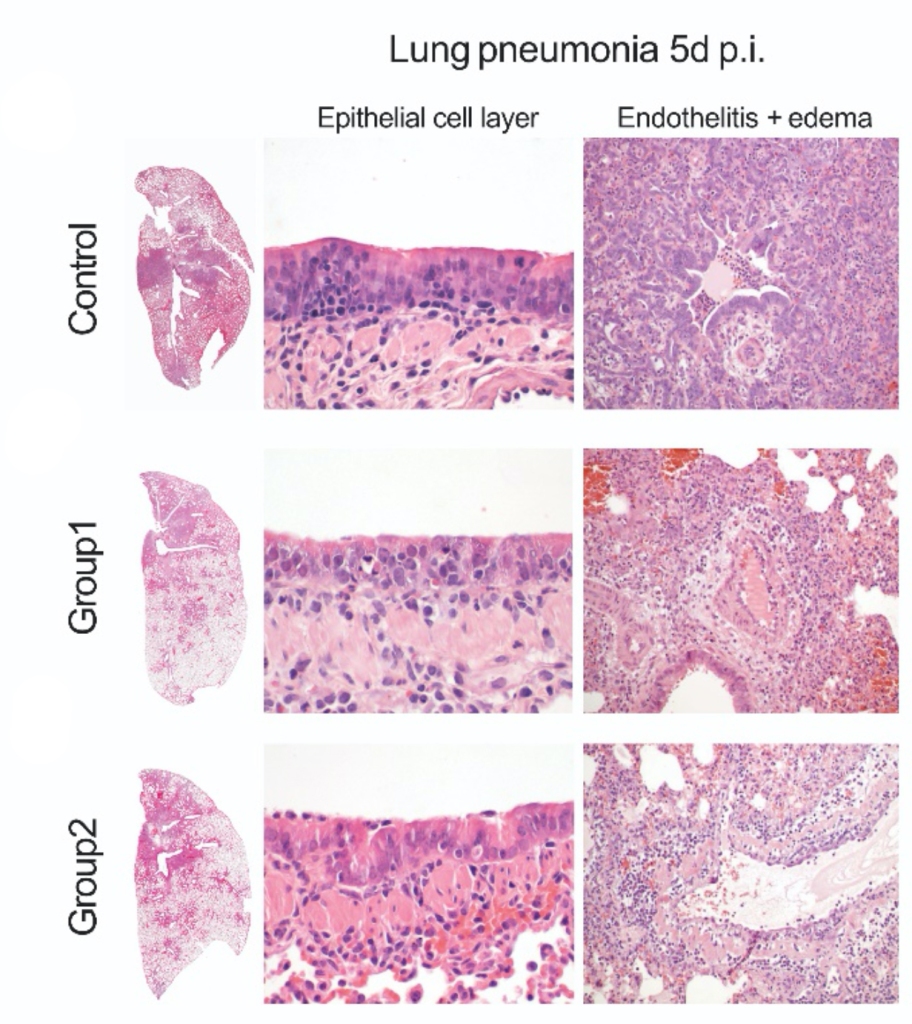
Wie das bei Menschen gebräuchliche COVID-19-Medikaments Dexamethason reduziert der Hsp90-Hemmer Ganetespib also nicht das Virus, wohl aber die Entzündung und damit die Krankheitsschwere. Der Effekt ist aber nicht sehr groß, und weiterhin ist unklar, ob das Medikament im Menschen etwas bewirken würde. Das Potenzial ist denn auch gar nicht so sehr als COVID-19-Medikament; weil es gegen Entzündungsmechanismen an sich wirkt und nicht gegen das Virus, könnte es bspw. auch bei Lungenentzündungen von Bakterien oder anderen Viren helfen. Daher werden wir die Möglichkeiten von Hsp90-Hemmern in Infektionskrankheiten im Rahmen des Covipa-Konsortiums der Helmholtz-Gemeinschaft weiter erforschen.
Vor zwei Jahren begannen die Impfungen gegen das Coronavirus SARS-CoV-2. Von den damals neuartigen mRNA-Impfstoffe wurden mittlerweile gegen eine Milliarde Dosen verwendet. Entsprechend sind sie ein wichtiges Thema in der biomedizinischen Forschung geworden, bislang einige Tausend Studien haben ganz unterschiedliche Aspekte beleuchtet. Dazu gehört die Beobachtung, dass die mRNA-Impfstoffe auch Antikörper vom Typ IgG4 gegen das Spike-Protein des Virus erzeugen. Die entsprechende Studie erschien im Juli 2022 als Preprint, und im Dezember in begutachteter Form. Anfang Januar wurde die Kernaussage von einer weiteren Studie bestätigt. Da die Corona-Impfung so breit angewendet wurde, in der Wissenschaft ein so wichtiges Thema geworden ist, und in der Öffentlichkeit teilweise auch stark polarisiert, erhielt die Studie sehr viel Aufmerksamkeit. Unter anderem wurde sie auch verwendet, um die Impfung als gefährlicher als bisher bekannt darzustellen. Auch deswegen ist die Studie ein so gutes Beispiel, wie solche neuen Erkenntnisse verstanden, eingeordnet und interpretiert werden können.
Grundlagen für das Verständnis der Studie
Erst einmal braucht es die Grundlagen um die Studie überhaupt zu verstehen. Es geht um Antikörper; das sind Moleküle in unserem Körper, die bspw. Viren erkennen. Um die Antikörper zu produzieren, braucht es B-Zellen. Von denen haben wir viele Millionen „naive“ im Körper. Wenn ein sogenanntes „Antigen“ in den Körper kommt, bspw. ein Virusbestandteil durch Impfung oder Ansteckung, werden einige der naiven B-Zellen aktiviert: diejenigen, die einen – einigermaßen – passenden Antikörper herstellen können. Durch die Aktivierung „reift“ eine solche B-Zelle. Sie verändert ihr Erbgut, damit ihr Antikörper das Antigen besser erkennt. Zudem verändert sie den Typ von Antikörpern, den sie herstellt. Zu Beginn ist das IgM, später IgG. Die Abkömmlinge der B-Zelle sind Plasmablasten, die den Antikörpern in großen Mengen herstellen, und Gedächtnis-B-Zellen. Diese können Jahrzehnte im Körper überdauern, und werden beim nächsten Kontakt (Impfung oder Ansteckung) mit dem Antigen reaktiviert. Drei Details sind für das Thema hier wichtig:
1. Der Wechsel des Antikörper-Typus ist gewissermaßen eine Einbahnstraße. Von IgM geht es zu IgG3/1, dann zu IgG2, und bis zum Ende der Einbahnstraße, zu IgG4. Wenn eine bestimmte B-Zelle bei IgG4 angekommen ist, geht es nicht mehr zurück.
2. Entsprechend sind in Erwachsenen die Typen IgG2 und IgG4 häufiger als in Kindern, und die zunehmende Reifung der B-Zellen geht im Durchschnitt mit höherem IgG4-Anteil einher. Und: die Antikörper-Reifung ist bei den mRNA-Impfstoffen besonders gut, was wahrscheinlich zu ihrer guten Wirksamkeit beiträgt.
3. Antikörper können ein Virus direkt unschädlich machen, indem sie sich an ihn anheften. Oder sie aktivieren andere Teile des Immunsystems („Virus ist hier!“). Das machen im Prinzip alle Antikörper-Typen, IgG4 aber weniger stark als andere.
Die Kernaussagen der Studien
Als nächstes ist die Frage, was in der Studie überhaupt gefunden – aber auch was nicht angeschaut wurde. Untersucht wurde das Blut von Menschen zu unterschiedlichen Zeitpunkten nach den Corona-Impfungen. Die Kernaussagen sind relativ einfach (und qualitativ hochwertig):
1. Nach der zweiten Impfung ist ein messbarer Anteil der Antikörper, die sich gegen das Virus richten (genauer gesagt gegen das Spike-Protein des Coronavirus SARS-CoV-2) vom Typ IgG4.
2. Nach der dritten Impfung gibt es nochmals einen Sprung im IgG4-Anteil. Das geschieht auch bei einer Infektion nach zwei Impfungen, wenn auch nicht so stark. Unabhängig davon war der überwiegende Anteil in allen Messungen der „Standard-Typ“ IgG1.
3. Mit dem AstraZeneca-Corona-Impfstoff ist der IgG4-Sprung nicht sichtbar; und nur schwach, wenn vor den mRNA-Impfungen noch eine Infektion war.
Was nicht gemessen wurde, für die Interpretation (siehe später) aber interessant wäre, war bspw.: wie hoch die Gesamt-Menge IgG4 im Blut war, oder ob/wie stark die Proband*innen mit hohen bzw. niedrigen IgG4-Werten später an COVID-19 erkrankten.
Was bedeutet das für die Bewertung der Impfung?
Was natürlich in der Anwendung vor allem interessiert: bedeutet diese Erkenntnisse, dass die mRNA-Impfstoffe anders bewertet werden müssen? Nun ist es so, dass in der Medizin molekular- und zellbiologische Erkenntnisse nicht immer entscheidend sind. Ob ein Medikament oder eine Impfung angewandt wird, wird nach anderen Kriterien bewertet: Wirkt es? Wenn ja, bei wem, unter welchen Umständen, wie gut? Wie sind die Risiken und Nebenwirkungen? Dafür werden andere Arten von Studien gemacht. Für die Frage, ob die dritte Impfung (die zu dem großen IgG4-Sprung führt) sinnvoll ist oder nicht, werden Gruppen von Zehn- bis Hunderttausenden Menschen mit und ohne dritte Impfung verglichen. Und eine Vielzahl solcher Untersuchungen zeigte, dass die dritte Impfung vor symptomatischer Ansteckung wie auch vor schwerer Erkrankung schützt (Beispiel hier). Studien wie die hier besprochen können also Hinweise geben, warum die Impfung wirkt wie sie wirkt, aber nicht ob sie wirkt.
Auch interessant: Für eines der am häufigsten verwendeten Medikamente, Paracetamol, ist nach wie vor nicht ganz klar wie es wirkt – was die Anwendung nicht bremst, weil genau bekannt ist, wie es anzuwenden ist und was die Risiken sind (Leberschäden nach mehreren Gramm pro Tag).
Aber was ist schon über IgG4 bekannt?
Auch wenn die Studien an sich nicht sagen können, was die IgG4-Beobachtung für die Impfung bedeutet: man kann trotzdem schauen, was wir aus dem Abgleich mit dem bisherigen Wissen zu IgG4 lernen, und eventuell daraus folgern können. Dabei sind zwei Dinge zu beachten: wir können nur auf das bekannte Wissen zu IgG4 zugreifen, und das kann uns auch in die Irre führen. Und, biologische Abläufe sind immer abhängig von der Situation in der sie stattfinden. Ein Beispiel ist die „Entzündung“, also die starke Aktivierung von Teilen des Immunsystems. Sie kann schädlich sein (wie die „Lungenentzündung“ in COVID-19, die mit immundämpfenden Medikamenten behandelt wird), ist aber grundsätzlich lebensnotwendig für die Abwehr von Krankheitserregern.
Wenn man nun also IgG4 bspw. googelt, kommen ganz oben die „IgG4-assoziierten Autoimmunerkrankung“. Bei Autoimmun-Erkrankungen macht das Immunsystem Antikörper gegen die Organe des eigenen Körpers. Grundsätzlich liegt das daran, dass das Aussortieren der entsprechenden B-Zellen nicht ganz funktioniert hat. Bei einigen dieser Autoimmun-Erkrankungen werden erhöhte Werte von IgG4 im Blut festgestellt – dabei wird aber das Gesamt-IgG4 gemessen, und nicht der Anteil IgG4 an ganz speziellen Antikörpern, wie bei den Corona-Impfungen. Insbesondere ist das IgG4 bei den Autoimmun-Erkrankungen die Folge und nicht die Ursache der Erkrankung – möglicherweise ist die permanente Aktivierung der problematischen B-Zellen durch körpereigenes Gewebe die Ursache für die hohen IgG4-Werte.
Die Forschung zu IgG4 bei Autoimmun-Krankheiten hilft uns wahrscheinlich also wenig weiter, da wir ja wissen wollen was geschieht, wenn gegen ein Virus viel IgG4 da ist. Nur, zur Rolle von IgG4 in Infektionskrankheiten gibt es kaum Studien. Bekannt ist, dass Menschen mit schweren COVID-19-Verläufen etwas mehr IgG4-Antikörper gegen das Virus ausbilden (Studie von vor der Impfung); dazu ist aber auch wichtig zu wissen, dass, je schwerer die Krankheit ist nach Ansteckung mit SARS-CoV-2 desto mehr Antikörper gegen das Virus gemacht werden. Wahrscheinlicher ist also (unter Einbezug dessen, dass die dritte Impfung vor schwerer Krankheit schützt), dass mehr IgG4 Folge und nicht Ursache des schwereren Krankheitsverlaufs ist.
Interessant ist aber eine kürzlich erschiene Studie, die bei Kindern mit Dengue-Virus-Ansteckungen IgG4 gemessen hat. Dabei gingen höhere Anteil von IgG4 unter den Virus-Antikörpern mit einem Schutz vor schwerer Krankheit einher. Diese Studie war genau so aufgebaut, dass sie die wesentliche praktische Frage beantwortet: welchen Einfluss hat die Menge IgG4 jetzt auf die nachfolgende Ansteckung?
Und was bedeutet das nun für die Zukunft der mRNA-Impfung?
Schlussendlich interessiert, was wir über die Ursachen und die Folgen der erhöhten IgG4-Anteile lernen können. Die Ursachen sind wahrscheinlich einem mRNA-Impfung-spezifischen Effekt zu finden (möglicherweise in Zusammenhang mit der von ihnen erzeugten sehr guten Antikörper-Reifung), zusammen mit wiederholten Antigen-Kontakten. Die molekularen und zellulären Folgen sind natürlich unklar; auch wenn die Dengue-Virus-Studie eher für einen positiven als einen negativen Effekt spricht. Relevant für die Bewertung der mRNA-Impfung ist aber sowieso die „medizinische Ebene“. So ist bspw. die Krankheitslast in der mehrheitlich dreifach mRNA-geimpften Bevölkerung in Deutschland ist diesen Winter nicht höher geworden, was dagegen spricht, dass mRNA-Impfung langfristig negative Folgen haben. Insgesamt eröffnen die IgG4-Studien also ein sehr interessantes neues Forschungsfeld, das viel zum Verständnis und der Behandlung von Infektionskrankheiten beitragen kann. Für die allgemeine Bewertung der mRNA-Impfung .
Schon seit Jahrzehnten wird es gemacht, so richtig durchgestartet ist es erst mit der Corona-Pandemie: die Beobachtung von Viren im Abwasser. Seit den 1980ern wird in verschiedenen Ländern das Abwasser auf das Polio-Virus getestet, das zur Familie der Enteroviren gehört und die Kinderlähmung verursacht. Mit den Impfkampagnen seit den 1970ern wurde Polio weltweit fast ausgerottet – aber eben nur fast. Nach 25 Jahren monatlichen Messungen in Proben aus Kläranlagen wurde es bspw. 2013 in Israel wieder gefunden. Danach wurde die Impfkampagne nochmals intensiviert.
Schon im ersten Halbjahr 2020 zeigten erste Studien, wie gut die Menge des Coronavirus SARS-CoV-2 in der Bevölkerung im Abwasser nachweisbar war. Es folgte ein regelrechter Abwasser-Boom, denn schnell war klar: mit dieser riechender Brühe kann man nicht nur sehen, wieviel Virus umgeht, sondern auch welche Varianten. Hunderte Wissenschaftliche Publikationen, ein Abwasser-Startup als „TIME most influential company„, der Erwähnung in einer G7-Abschlusserklärung und vielerlei anderen Erwähnungen später war klar: Abwasser-Beobachtung kann uns helfen, SARS-CoV-2 zu verstehen und in den Griff zu kriegen.
Klar ist auch: wenn dieses Virus im Abwasser drin ist, dann sicher noch viele andere Mikroben. In den letzten zehn Jahren gab es einige Studien, die die Erbgutschnitzel im Abwasser auslasen. Diese Daten zeigen, welche Bakterien, Viren, Parasiten oder Pilze im Abwasser drin sind – oder deren Erbgutschnitzel ins Abwasser abgegeben wurden. Denn gerade für SARS-CoV-2 ist es wahrscheinlich nicht so, dass im Stuhl ganze Viren drin sind, sondern nur Stücke vom Virus-Erbgut.
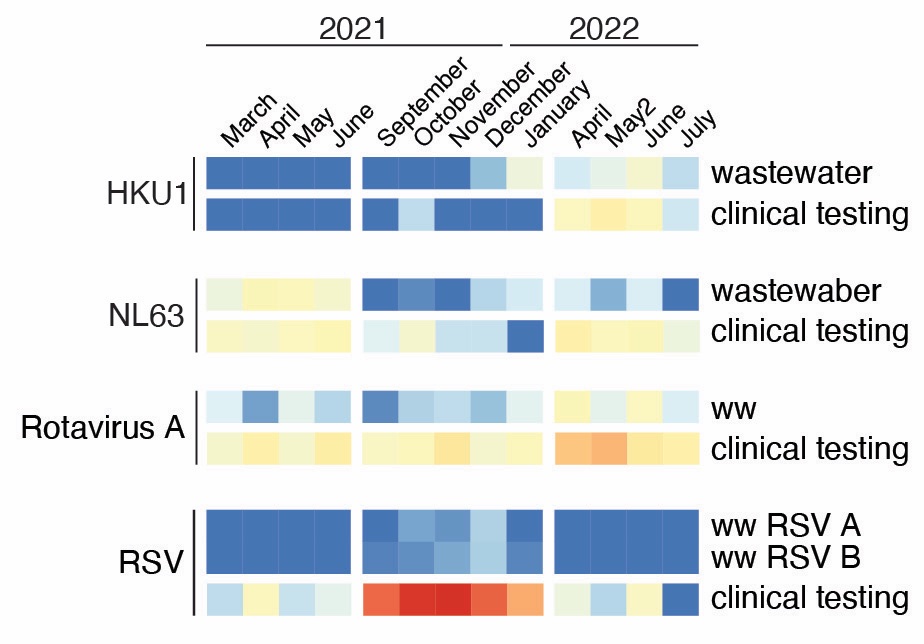
Mit unserer Studie wollten wir zwei Fragen beantworten: wie verändern sich die Viren im Abwasser über den Jahresverlauf? Und wie detailliert können wir welche Arten von Viren im Abwasser nachverfolgen? Dazu sammelten wir über 100 Proben eines Berliner Klärwerkes von März 2021 bis Juli 2022, und bestimmten die Sequenzen der Erbgutschnipsel mit Hochdurchsatz-Sequenzierung, und ordneten sie bekannten Virenarten zu.
Der überwiegende Teil der Erbgutinformation im Abwasser stammt von Bakterien; auch Parasiten aller Art sind gut vertreten, und bei den Viren sind die Pflanzenviren (vor allem je ein Tomaten-, Gurken- und Paprikavirus) am häufigsten. Sehr gut sichtbar sind Durchfallviren, v.a. die Astroviren, die (außer bei Mangelernährung oder Immunschwäche) milde bis kaum spürbare Magen-Darm-Infektionen verursachen. Das Abwasser zeigt dabei ihre enorme Variantendynamik über die Zeit. Im Vergleich zu SARS-CoV-2 ist ihr Erbgut deutlich kleiner und verändert sich viel schneller – schwierig für das Immunsystem. Auch viele verschiedene Enteroviren waren sichtbar – dazu gehören etwa Rhinoviren (Schnupfen) oder Coxsackieviren (Hand-Fuß-Mund-Krankheit). Die Mengen von Erbgutschnipseln der jetzt ja wieder sehr akuten Atemwegsviren RSV oder Grippe waren im Vergleich deutlich kleiner, und konnten nur mit biochemischen Anreicherungen gesehen werden. Trotzdem waren die entsprechenden Virus-Wellen im letzten Winter im Abwasser gut sichbar:
Das Abwasser zeigt aber nicht nur was bekannt ist. Insgesamt fanden wir einige Zehntausend neue Viren, indem wir nach bekannten Erbgut-Mustern suchten. Wohl die allerwenigsten davon können Säugetiere infizieren, eher sind ihre Wirte Bakterien, Einzeller (Amöben) oder Insekten. Abwasser ist damit nicht nur ein Weg, um Krankheitserreger zu beobachten – es ist auch eine reichhaltige Quelle, um die Gesamtheit der Viren auf unserem Planeten erfassen und verstehen zu können.
Eine Ansteckung mit dem Coronavirus SARS-CoV-2 kann zu ganz unterschiedlichen Krankheitsverläufen führen. Während einige kaum oder nichts merken, ist das Virus für andere lebensgefährlich. Diese große Bandbreite gibt es nicht nur in der akuten Phase, also in den ersten 1-3 Wochen nach Ansteckung. Während viele danach komplett genesen, leiden andere Menschen Wochen bis Monate oder sogar Jahre unter den Nachwirkungen der Infektion. Üblicherweise wird dafür (und der Einfachheit halber auch in diesem Text) der Begriff „Long Covid“ verwendet – der Fachbegriff ist „post-akute Folgeerscheinungen einer Infektion“, zudem wird genau genommen zwischen Long Covid (bis drei Monate nach Ansteckung) und Post Covid (länger als drei Monate nach Infektion) unterschieden.
Es ist schon von vielen verschiedenen Viren bekannt, dass eine Ansteckung damit zu lange anhaltenden Beschwerden führen kann. Dazu gehören chronische Erschöpfung, Muskelschmerzen oder Störungen der Gehirnfunktion wie Konzentrationsschwäche, Wortfindungsstörungen, Vergesslichkeit usw. – alles kann auch bei Long Covid auftreten. Speziell bei SARS-CoV-2 gibt es zudem Verlust bzw. Störung des Geruchs- und Geschmackssinnes oder Kurzatmigkeit.
Die Impfung macht nicht nur einen schweren akuten Kankheitsverlauf weniger wahrscheinlich, sondern zu einem gewissen Grad auch Long Covid. Zudem scheint es mit der seit Dezember 2021 dominierenden Omicron-Variante seltener zu sein als vorher. Trotzdem ist davon auszugehen, dass zu den bestehenden, mehreren Millionen Fällen in Europa noch viele dazukommen werden. Entsprechend intensiv wird die Forschung nach den Ursachen und möglichen Therapien vorangetrieben, bspw. in einer neuen Förderlinie des Deutschen Bundesministeriums für Bildung und Forschung. Die Erkenntnisse könnten nicht nur Patient*innen mit Long Covid zu Gute kommen, sondern auch bei verwandten Krankheitsbildern wie ME/CFS mit anderen Ursachen helfen.
Der aktuelle Stand der Wissenschaft geht davon aus, dass es unterschiedliche „Kategorien“ von Long Covid gibt, mit jeweils unterschiedlichen Ursachen (CoronaInfo vom 16. März 2022, Ärzteblatt). Drei davon erscheinen zur Zeit am wahrscheinlichsten. Die erste ist eine andauernde Entzündung, aber ohne dass noch Virus im Körper ist. Teile des Immunsystems sind dabei in einem ständigen „Alarmzustand“. Das führt zu Müdigkeit und Gliederschmerzen, kann aber auch zu kleinen Blutgerinnseln führen, die wiederum die Funktion von Herz, Hirn usw. beeinträchtigen können. Zweitens gibt es mehrere Hinweise, dass das Virus im Körper bleibt – sei es als ganzes, und vielleicht auch sich vermehrend, oder auch nur Bruchstücke davon, bspw. im Darm. Auch hier können die Beschwerden von der permanenten Aktivierung des Immunsystems herrühren. Und drittens wird vermutet, dass durch die Infektion das Immunsystem sogenannte „Autoantikörper“ produziert, die gegen Teile des eigenen Körpers gerichtet sind und somit Schaden anrichten.
Es besteht aber nicht nur Unklarheit über die Ursachen, es ist auch von verschiedenen, teilweise wohl überlappenden Mechanismen der Krankheitsentstehung auszugehen. Daher wird eine Vielzahl von Medikamenten ausgetestet. Im Vordergrund stehen solche, die auf das Immunsystem wirken. Diese sind oft schon bei anderen Krankheiten wirksam, aber auch schwierig anzuwenden; denn Substanzen, die das Immunsystem dämpfen, können bspw. anfälliger für Infekte machen. Dazu kommen verschiedene neuartige Methoden wie bspw. das experimentelle Medikament BC007, das Autoantikörper neutralisieren soll, oder eine „Blutwäsche“, um Autoantikörper oder Immun-Botenstoffe aus dem Blut zu filtern. Eine robuste Wirksamkeit hat noch keine Therapie gezeigt; bspw. gab es im ersten Halbjahr 2021 die Hypothese, dass die Impfung gegen Long Covid helfen würde, indem es Virusreste (die zweite Ursache in der Auflistung oben) beseitigen würde. Die Ergebnisse waren aber gemischt, auch Verschlechterungen traten auf.
Ob und wie heftig Long Covid auftritt, ist von Mensch zu Mensch unterschiedlich. Dazu kommen verschiedene mögliche Ursachen. Erfolgreiche Therapien werden daher wahrscheinlich individuell „maßgeschneidert“ sein müssen. Neben einer Vielzahl von Labormessungen gehört dazu auch eine umfassende Begleitung aus verschiedenen therapeutischen Disziplinen. Entsprechende Sprechstunden sind schon in Betrieb, bis zu einer erfolgreichen und schnellen Behandlung der so vielen Fälle wird es aber noch ein langer Weg sein.
Weiterführender Artikel (Englisch): Long-COVID treatments: why the world is still waiting
Die meisten Menschen sind zwei- oder dreimal geimpft gegen das Coronavirus SARS-CoV-2, und/oder schon einmal oder mehrfach davon genesen. Das Virus ist aber immer noch da. Auch wenn es mittlerweile deutlich seltener vorkommt, dass Menschen nach einer Ansteckung ins Krankenhaus müssen oder sterben: viele sind über viele Tage krank zu Hause, einige haben auch nach Wochen oder Monaten noch Beschwerden. Oft fragen man daher sich (oder mich): ist jetzt der Zeitpunkt für die nächste Impfung?
Glasklare Antworten gibt es dafür leider nicht – das ist übrigens auch der Grund warum in der öffentlichen Diskussionen so viele unklare und gegensätzliche Botschaften rumschwirren. In diesem Beitrag möchte ich daher aufzeigen, welche Erwägungen relevant sind, bzw. wie der aktuelle Stand der Wissenschaft ist.
Ganz wichtig: diese Information hier ersetzt nicht den ärztlichen Rat, und insbesondere bei Unsicherheit sollte die Entscheidung in Absprache mit Arzt oder Ärztin getroffen werden!
1. Warum stellt sich die Frage überhaupt?
Die allermeisten Menschen haben mittlerweile eine gewisse Immunität gegen das Virus, durch Impfung oder Genesung, häufig auch eine Kombination von beidem. Der Schutz vor schweren Krankheitsverläufen ist robust und langlebig, der vor Infektion an sich nicht. Schon nach wenigen Monaten reicht die Immunität dafür nicht mehr aus, vor allem weil sich Varianten des Virus durchsetzen, die ihr entgehen können – erst das „Ur-Omikron,“ und noch viel mehr die aktuellen Omikron-Untervarianten wie BA.5 oder BA.2.75.
2. Und was ist das Risiko einer Ansteckung?
SARS-CoV-2 stellt nicht mehr dieselbe Gefahr dar wie vor zweieinhalb Jahren. Trotzdem, ein einfaches „Erkältungsvirus“ ist es bei weitem nicht. Auch ansonsten gesunde, geimpfte/genesene Menschen kann es zwei Wochen sehr krank machen (auch wenn das nicht gleich Krankenhaus bedeutet), und darüber hinaus für viele Wochen bis Monate Beschwerden verursachen. Und für besonders gefährdete Menschen (ältere, mit Vorerkrankungen, Immunschwäche oder immun-unterdrückenden Medikamenten) kann eine Ansteckung nach wie vor schwerwiegende Folgen haben.
Andererseits: die Gefahr, sich jetzt im Sommer anzustecken, ist nicht so hoch wie im Winter – und gegen eine Ansteckung im Winter hilft eine Impfung im Oktober natürlich besser als eine jetzt im Juli. Auch wenn den Inzidenz-Zahlen nicht mehr so richtig zu trauen ist, zeigen die Abwasser-Daten aus Österreich oder der Schweiz schon recht klar eine Abflachung der „Sommerwelle“, wie schon in Portugal vor zwei Monaten. Und trotz allem haben viele Menschen die sich jetzt anstecken tatsächlich nur eine leichte „Erkältung“.
3. Na gut, aber dann doch einfach nochmals Impfen, sicherheitshalber?
Leider ist es nicht ganz so einfach, und daher kommt auch das Zögern bezüglich der Empfehlungen. Erstens ist der Zusatznutzen bspw. einer vierten Impfung bei ansonsten gesunden, schon 3x geimpften jüngeren Menschen (oder eine dritte Impfung wenn 2x geimpft und 2xgenesen, usw.) eher klein. Zweitens ist mittlerweile klar, dass es zumindest in – einem gewissen Maß – eine Form von „Immun-Einprägung“ gibt. Das bedeutet schlussendlich, dass die noch für das ursprüngliche Virus gemachten Impfstoffe den Schutz vor aktuellen und zukünftigen Varianten bei wiederholter Anwendung sogar schmälern können. Drittens, neben den durchaus unangenehmen Impfreaktionen (1-3 Tage Fieber, Müdigkeit usw.) kann es, selten aber nicht nie, schwerere Nebenwirkungen geben.
4. Dann auf den angepassten Impfstoff warten?
Sowohl Moderna wie auch Biontech/Pfizer haben erste Daten zu auf Omikron angepassten Impfstoffen vorgestellt. Die sind zwar durchaus vielversprechend, aber auch nicht ganz überragend, und es ist noch nicht klar, ob und wann diese angepassten Impfstoffe durch die europäische Arzneimittelbehörde zugelassen werden. Und auch dann: erstmal wird es eine Zulassung für die Omikron-Form von Ende 2021 geben, die auch nicht mehr so gut zu dem passen wird, was wir dann hier ab Oktober haben werden (und hoffentlich gibt es keine unangenehme Überraschung mit einer ganz neuen Virusvariante).
5. Wenn jetzt impfen, welchen Impfstoff nehmen?
Mittlerweile ist die Auswahl größer geworden – seit einigen Monaten gibt es den Protein-Impfstoff von Novavax auch hier, und seit kurzem auch den Totimpfstoff von Valneva. Mittlerweile gibt es auch schon recht ausführliche Daten zu den Impfreaktionen/-Nebenwirkungen bspw. aus Südkorea (Novavx wird v.a. in Ostasien und Indien verimpft), die das anfängliche Bild der geringeren Impfreaktionen/-Nebenwirkungen bestätigen. Insbesondere wenn die RNA-Impfstoffe nicht so gut vertragen wurden, oder das Risiko schwerer Nebenwirkungen höher ist (für Herzmuskelentzündungen bspw. bei jungen Männern), kann durchaus die Frage nach der Wahl des Impfstoffes auf den Tisch kommen.
Vorläufiges Fazit?
Ob jetzt eine weitere Impfung sinnvoll ist, kann nur in Abwägung der erwähnten Punkte aus der konkreten Situation heraus erfolgen – und ohne eine gute Portion Bauchgefühl wird es nicht gehen.
